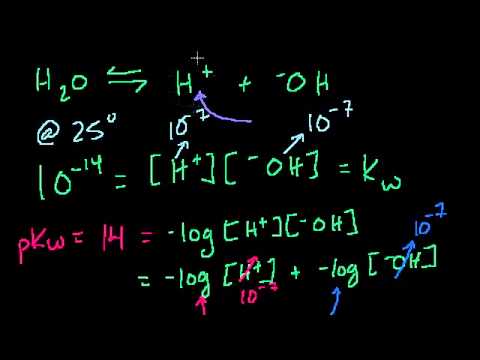
Зміст
Будучи студентом хімії, одна з основних навичок, яку ви засвоюєте, - це обчислення рН і pOH кислот і основ. Поняття та розрахунок не є складними, якщо ви знайомі з логарифмами та концентрацією розчинів.
TL; DR (Занадто довго; Не читав)
Для обчислення рН = - log (H3O+ концентрація іонів). Розрахунок для pOH становить - log (OH- концентрація іонів).
Значення рН і pOH
Для кислот і основ концентрація розчину передбачає числа, які можуть змінюватися в широкому діапазоні значень - від мільйона до одного. На відміну від більшості одиниць, лінійних, pH та pOH, обидва базуються на загальному (базовому 10) логарифмі, що дозволяє виражати значення однією або двома цифрами, які в іншому випадку могли б охопити багато порядків. Хоча до цього потрібно звикати, компактність одиниць pH та pOH є зручною та економить час та плутанину. Одиниця pH вказує на кислотність, де менші числа означають більші концентрації H3O+ (гідронієві) іони і становлять від понад 14 (дуже лужні) до негативних чисел (дуже кислотні; ці від’ємні числа використовуються в основному в академічних цілях). За цією шкалою деіонізована вода має рН 7. Шкала pOH дуже схожа на рН, але зворотна. Він використовує ту саму систему нумерації, що і рН, але вимірює ОН- іони. У цій шкалі вода має однакове значення (7), але ви знайдете основи на нижньому кінці та кислоти на високому кінці.
Розрахунок рН
Для обчислення рН від молярної концентрації кислоти візьміть загальний журнал H3O+ концентрацію іонів, а потім помножте на -1: pH = - log (H3O+). Наприклад, що таке рН 0,1 М розчину соляної кислоти (HCl), припускаючи, що кислота повністю розчленовується на іони в розчині? Концентрація Н3О+ іонів - 0,1 моль на літр. pH = - log (.1) = - (- 1) = 1.
Розрахунок pOH
Розрахунок для pOH дотримується тих же правил, що і для pH, але використовує концентрацію ОН- іони: pOH = - log (OH-). Наприклад, знайдіть pOH 0,02 М розчину гідроксиду натрію (KOH). Концентрація ОН- іонів - 0,02 моль на літр. pOH = - log (.02) = - (- 1,7) = 1,7.
Додавання рН і pOH
При обчисленні як рН, так і pOH даного розчину цифри завжди дорівнюють 14. Наприклад, pH і pOH води - 7, а 7 + 7 = 14. 0,02 М розчин гідроксиду натрію в прикладі вище буде мати pH 12,3. Це означає, що якщо ви знаєте рН, ви можете відняти його від 14, щоб знайти pOH, і навпаки.